Bulk-RNA测序上游分析——从reads到counts
转录组基础知识
以下记载了转录组最基础的一些知识,这些概念在RNA测序分析中是至关重要的:
1、基因组Genome:指某一特定物种细胞内或病毒颗粒内的一整套遗传物质(DNA或RNA)。对于人类而言,人类细胞是二倍体,有2套染色体,其中任何一套染色体的DNA序列即为一个基因组,比如人类基因组就是1-22号染色体+X+Y。在广义上,线粒体DNA也可以算作基因组的一部分。
2、转录组Transcriptome:广义上指在某种条件下在一个细胞或一群细胞中所转录出的RNA总和,包括mRNA、rRNA、tRNA和其他非编码RNA等。狭义的转录组特指转录出的mRNA。转录组和基因组的差别在于,基因组在给定的细胞株上一般不变,而转录组可能会有很大变化,它反映了在给定条件下细胞内活跃表达的基因,故也成为“基因表达谱”。
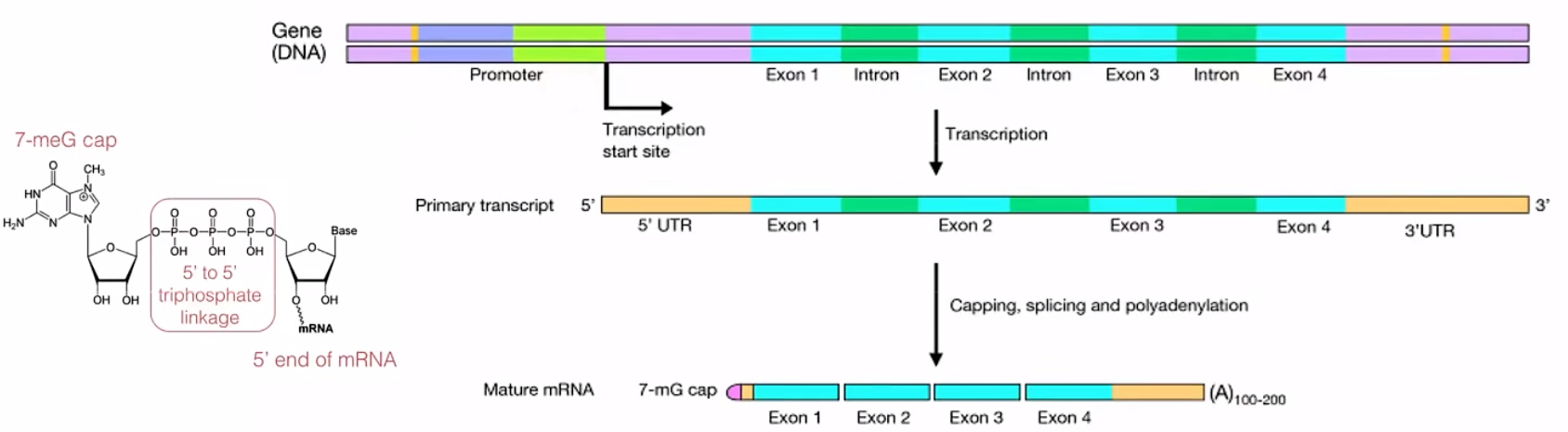
3、转录Transcription:即在RNA聚合酶的作用下,遗传信息由DNA复制到RNA的过程。其分为三个过程:启动、延伸和终止。由RNA聚合酶和转录因子共同结合到模板DNA的启动子序列上开启转录过程,接着按互补配对原则进行延伸,最后通过依赖ρ因子的终止或非依赖ρ因子的终止来终止转录。转录出的初级转录RNA包括以下区域:5’UTR(5’非翻译区)、3’UTR(3’非翻译区)、Intron(内含子)、Exon(外显子)。
4、转录后修饰Post-transcriptional modification:是指在真核细胞中,将初级转录RNA转化为成熟RNA的过程。包括3个过程:5’端加帽、3’端加尾以及RNA剪切。
5、可变剪接Alternative splicing:又称可变剪接,即一条未经剪接的RNA,含有的多种外显子被剪成不同的组合,因而翻译成不同的蛋白质。剪切出的不同mRNA即为mRNA异构体(isomer)。
6、转录本Transcript:即一条mRNA。一条基因可能有不同的转录本,其中一个原因就是可变剪切。
硬件和软件的准备
1、个人计算机的准备:
-
操作系统:Ubuntu 24.04 LTS
-
RAM:16G;硬盘:500G
2、软件的准备。
-
不具体介绍某个软件的下载方法
-
一般的软件安装命令方法如下:
1
|
sudo apt install Name_of_Software
|
-
或者直接在Github等网站上下载
3、将软件所在位置添加入环境变量,或将PYTHON脚本添加到PYTHON环境变量:
1
2
3
|
echo 'export PATH=path/to/your/software:$PATH' >> ~/.bashrc
echo 'export PYTHONPATH=path/to/your/python_script:$PYTHONPATH' >> ~/.bashrc
source ~/.bashrc #重新加载环境变量
|
FASTQ和FASTA文件概述
RNA测序分析的第一步是从测序的原始数据开始的。测序公司返回的原始数据文件是FASTQ格式,里面的每一条记录就是一个read读段。还有一种类似的数据格式叫做FASTA,一般用来记录已经组装好的、参考基因组的序列。
使用以下命令下载本例所需的文件:
1
2
3
4
5
|
wget ftp://hgdownload.cse.ucsc.edu/goldenPath/hg19/encodeDCC/wgEncodeCaltechRnaSeq/wgEncodeCaltechRnaSeqGm12892R2x75Il200FastqRd1Rep2V2.fastq.gz
wget ftp://hgdownload.cse.ucsc.edu/goldenPath/hg19/encodeDCC/wgEncodeCaltechRnaSeq/wgEncodeCaltechRnaSeqGm12892R2x75Il200FastqRd2Rep2V2.fastq.gz
wget ftp://ftp.ensembl.org/pub/release-74/fasta/homo_sapiens/dna/Homo_sapiens.GRCh37.74.dna.toplevel.fa.gz
|
其中,前两个文件为来自淋巴母细胞系的双端测序文件,数据在加利福尼亚理工学院产生,来自早期Illumina平台。下载完毕后解压并重命名为Read1.fastq,Read2.fastq。第三个文件是从ENSRMBL网站上下载的人类参考基因组,解压后大小约为30Gb。下载完解压并重命名为Homo_sapiens.GRCh37.74.dna.toplevel.fa。
分别打开Read1.fastq和Read2.fastq两个文件,可以发现其前四行分别为:
1
2
3
4
|
@HWUSI-EAS1665_28:5:1:1038:939/1
NNNNGGGGTAGGAGNNNNNNNNNGGAGCCAAGGGGGCGTGGCTACGATCTGTGGGACTATGACTGAAATGCTGTA
+
BBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBB
|
以及
1
2
3
4
|
@HWUSI-EAS1665_28:5:1:1038:939/2
GCACAGGCGGGGGTCACTCTTTTTTGGGTCCTCCGAAATTCGCGGGGAGGATTCAACATCACGAAGCTTGCCGCA
+
BBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBBB
|
Read1.fastq和Read2.fastq中每一条记录都是一一对应的,代表同一条mRNA的两端的序列。每一条fastq记录都由4行组成:
-
第一行记录了测序时的相关信息,其中@HWUSI-EAS1665_28是测序机器名称,5代表测序槽lane的序号,1代表测序小室tile的编号,1038和939分别是tile内的XY坐标,/1代表是正向测序序列,/2代表是逆向测序序列。
-
第二行是测得的mRNA序列,本里中所有的记录都是75bp的,用ATCG代表四种碱基,N代表不确定的模糊碱基。
-
第三行是一个加号(+)作为分隔符。
-
第四行是碱基的质量Q,Q为-10*lg(P)再四舍五入到整数,其中P是碱基错误的概率,再将Q加上33转化为ASCII码(phred33编码)【如果是低于1.8版本的Illumina软件产生的FASTQ文件则是Q+64转化为ASCII码(phred64编码),本例就是phred64编码的】。
接着,打开Homo_sapiens.GRCh37.74.dna.toplevel.fa,其前两行为:
1
2
|
>1 dna:chromosome chromosome:GRCh37:1:1:249250621:1 REF
NNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNNN…
|
该文件的每条记录都由2行组成:
质量控制与预处理
1、用fastqc对原始文件生成一个质量报告。
1
2
|
fastqc Read1.fastq.gz
fastqc Read2.fastq.gz
|
2、使用Trimmomatic【Trimmomatic版本0.39】过滤掉平均质量低于20(AVGQUAL:20)的read,采用双端测序模式(PE)。
1
2
|
cd RnaSeq_Fastq_data #注:下载的所有数据都是放在~/RnaSeq_Fastq_data文件夹下的,下不赘述
java -jar ~/software/Trimmomatic-0.39/trimmomatic-0.39.jar PE -phred64 Read1.fastq.gz Read2.fastq.gz paired1.fq.gz unpaired1.fq.gz paired2.fq.gz unpaired2.fq.gz AVGQUAL:20
|
其中生成的upaired1/2.fq.gz文件存储了经过过滤幸存、但失去其配对的read。
3、使用Trimmomatic修剪,当碱基质量低于20(TRAILING:20)时从3’端修剪碱基,并且去除修剪后长度低于50bp(MINLEN:50)的read。该命令作用于双端read。其他修剪方法暂略。
1
2
|
cd RnaSeq_Fastq_data
java -jar ~/software/Trimmomatic-0.39/trimmomatic-0.39.jar PE -phred64 Read1.fastq.gz Read2.fastq.gz paired1.fq.gz unpaired1.fq.gz paired2.fq.gz unpaired2.fq.gz TRAILING:20 MINLEN:50
|
4、接头的去除。案例中原始数据已经进行接头的去除,这里暂略接头的去除方法。
5、使用prinseq-lite【prinseq-lite版本0.20.4】进行筛选。去除长度小于50的read(-min_len 50),去除平均质量低于20的read(-min_qual_mean 20)【这一工作在已经在1和2中完成,可以省略】;去除低复杂度的read,即熵<70的read(lc_method entrophy lc_threshold 70);去除模糊碱基N>2的read(ns_max_n 2)。经过滤过后保留配对的文件存储在nfiltered_1/2.fastq中,经过滤过幸存、但失去其配对的read保存在nfiltered_1/2_single-tons.fastq中。这一步骤可能要计算数个小时。
1
|
prinseq-lite -fastq Read1.fastq -fastq2 Read2.fastq -min_len 50 -min_qual_mean 20 lc_method entrophy lc_threshold 70 ns_max_n 2 -out_good nfiltered -log -verbose
|
6、重复read的删除。在RNA-seq中,重复往往是对高度表达的转录本进行测序的自然结果(高表达导致测序重复数多),不建议删除重复。如有必要可以用prinseq-lite来处理,删除出现100次以上(-derep_min 101)的准确重复段(-derep 1)。
1
|
prinseq-lite -fastq Read1.fastq -fastq2 Read2.fastq -derep 1 -derep_min 101 -log -verbose -out_good dupfiltered -out_bad null -no_qual_header
|
将read比对到参考基因组
1、如前所述,在Ensembl上下载人类参考基因组:在http://ftp.ensembl.org/pub/release-74/fasta/homo_sapiens/dna上下载Homo_sapiens.GRCh37.74.dna.toplevel.fa.gz文件并解压,解压后的文件大小约为33Gb。
1
|
wget ftp://ftp.ensembl.org/pub/release-74/fasta/homo_sapiens/dna/Homo_sapiens.GRCh37.74.dna.toplevel.fa.gz
|
2、用bowtie2【bowtie2版本2.5.4】生成索引。
1
|
bowtie2-build ~/RnaSeq_Fastq_data/Homo_sapiens.GRCh37.74.dna.toplevel.fa/lustre/scratch110/ensembl/amonida/rel74/fasta_dumping_e74/fasta/homo_sapiens/dna/Homo_sapiens.GRCh37.74.dna.chromosome.1.fa GRCh37.74
|
该操作会创建6个bt2l文件,均以CRCh37.74作为索引基本名。该操作会花费数个小时。生成的6个文件是GRCh37.74.1.bt2l;GRCh37.74.2.bt2l;GRCh37.74.3.bt2l;GRCh37.74.4.bt2l;GRCh37.74.rev.1.bt2l;GRCh37.74.rev.2.bt2l。他们的基本名是CRCh37.74。
3、将read比对到基因组。这里参考的索引基本名是CRCh37.7(-x CRCh47.7),输入文件(-U Read1.fastq.gz)是fastq格式(-q),它使用phred+64编码(–phred64)。将结果(-S)输出到Read1aligned.sam的文件,这里面不包括未比对的read(–no-unal)。有8个处理器同时使用以加快对比速度(-p 8)。该操作会花费数个小时。
-
如果是单端测序:
1
|
bowtie2 -q --phred64 -p 8 --no-unal -x GRCh37.74 -U Read1.fastq.gz -S Read1aligned.sam
|
-
如果是双端测序:
1
|
bowtie2 -q --phred64 -p 8 --no-unal -x GRCh37.74 -1 Read1.fastq.gz -2 Read2.fastq.gz -S Readaligned.sam
|
#Bowtie2在进行比对时不需要原始的fasta文件,只需要用生成的6个索引文件即可完成比对。比对结束后Bowtie2按照SAM格式报告比对结果,本例中文件名为Readaligned.sam。
4、使用samtools【samtools版本1.19.2】对SAM文件进一步处理。
-
将SAM格式转化为BAM格式以节省空间,并且方便后续的操作。本例中指定输入是SAM文件(-S),输出是BAM文件(-b),输出文件名是alignments.bam(-o alignments.bam)。
1
|
samtools view -bS -o alignments.bam Readaligned.sam
|
-
在BAM中按染色体坐标进行排序,或者使用名称排序。
1
|
samtools sort -o alignments.sorted.bam alignments.bam
|
-
给BAM文件编制索引。
1
|
samtools index alignments.sorted.bam
|
这将会生成一个BAI索引文件alignments.sorted.bam.bai
-
指定一个染色体或染色体区域,制作对比的子集。本例提取18号染色体的比对制作比对的子集。
1
|
samtools view -b -o alignments.sorted.18.bam alignments.sorted.bam 18
|
-
基于作图质量过滤比对,本例中保留作图质量高于30的比对。
1
|
samtools view -b -q 30 -o alignments_MQmin30.bam alignments.bam
|
-
查看统计项目,如多少个read正确配对,或多少个read与其配对read作图到不同染色体等。
1
|
samtools flagstat alignment.bam
|
-
BAM文件索引添加“chr”,如将“1”变成“ch1”(如果需要):
1
|
samtools view -H H1Rep1.18.bam | sed -e 's/SN:\([0-9XY]\)/SN:chr**\1**/' -e 's/SN:MT/SN:chrM/' | samtools reheader - H1Rep1.18.bam > H1Rep1.18.chradded.bam
|
4、可视化比对的read。可以使用Intergrative Genomics Viewer(IGV)【IGV版本2.4.10】软件对BAM文件进行可视化。可视化过程需要两个文件,即alignments.sorted.bam,以及它的索引文件alignments.sorted.bam.bai。本例中java版本需要切换到java8才能运行IGV
讨论
讨论1:为什么要制作参考基因组索引?
将一条read(本例中为75bp)匹配到数以亿计bp的人类基因组并非一件容易的事,而匹配一个样本全部数十万条记录可能会花上数百年的时间。对参考基因组进行预处理,就如同给字典加上目录一样,在查询的时候只需要从目录定位大致位置,再在小范围内查找即可(而不是遍历整个字典)。为参考基因组制作索引可以大大减小比对的时间复杂度,从而优化查找时间。Bowtie2采用的是FM-index压缩技术,该技术基于Burrows-Wheeler Transform(BWT)和Suffix Array(后缀数组)算法,能够在占用较小内存的同时实现快速的子字符串匹配。此外,制作的索引包含了原始fasta文件的所有信息,故bowtie2在进行匹配时只需要用到索引即可,不需要原始fasta文件。在本例中:
-
GRCh37.74.1.bt2l、GRCh37.74.2.bt2l包含了FM-index的信息;
-
GRCh37.74.3.bt2l、GRCh37.74.4.bt2l包含了额外的索引结构辅助快速定位;
-
GRCh37.74.rev.1.bt2l、GRCh37.74.rev.2.bt2l包含了反向互补序列的FM-index信息。
此外,这些都是二进制文件,无法直接读取。
讨论2:SAM文件格式
SAM格式储存了bowtie2将read与参考基因组进行比对后的结果。SAM文件内容如下:
1
2
3
4
5
6
7
8
|
@HDVN:1.5SO:unsortedGO:query
@SQSN:1LN:249250621
…
@SQSN:GL000207.1LN:4262
@PGID:bowtie2PN:bowtie2VN:2.5.4CL:"~/software/bowtie2-2.5.4/bowtie2-align-l --wrapper basic-0 -q --phred64 -p 8 -x GRCh37.74 --passthrough -1 Read1.fastq.gz -2 Read2.fastq.gz"
HWUSI-EAS1665_28:5:1:1242:9501531762289734275M=762289730TACAGCTACAAGACCTTTCTTGAAAATCTTATTTAATTCTGAGCCCATATTTCACTTACCTTATTTAAAATAAAT92B
??B=:B?;;B-69>G=GFE=F@<4@@F@B55B4B,<=B4==<=3@88@B84<BB-:47B@?=32068=,--4AS:i:-3XN:i:0XM:i:1XO:i:0XG:i:0NM:i:1MD:Z:13A61YT:Z:UP
…
|
其中:
-
@HD行为文件头信息,包括版本(VN)、排序方式(SO)和排序方式(GO)
-
@SQ行为参考序列信息,包括染色体名称(SN)和长度(LN)
-
@PG行为程序信息,包括程序ID(ID)、程序名(PN)、版本号(VN)和指令(CL)
-
接下来每行都记录了一条比对信息,由11个必须字段和若干可选字段组成,中间用Tab分隔:
| 字段编号 |
字段名称 |
说明 |
| 1 |
QNAME |
序列名称,本例为HWUSI-EAS1665_28:5:1:1242:950 |
| 2 |
FLAG |
比对标志位,用于描述比对的特征和属性,这里153转化为2进制为10011001,代表8个参数 |
| 3 |
RNAME |
比对到的参考序列名称,这里1代表比对到1号染色体 |
| 4 |
POS |
对比的起始位置,这里之1号染色体的76228973位 |
| 5 |
MAPQ |
比对的可信度 |
| 6 |
CIGAR |
CIGAR字符串,这里75M指75个碱基完全匹配。不同字母所代表的含义不做展开 |
| 7 |
RNEXT |
指当前read的配对read比对到的参考序列名称。“=”代表二者对比到了同一个参考序列 |
| 8 |
PNEXT |
下一个比对的起始位置 |
| 9 |
TLEN |
模板长度,表示该read在参考序列上的覆盖长度。这里0代表数据不可用 |
| 10 |
SEQ |
read序列 |
| 11 |
QUAL |
read质量,phred64编码 |
| +1 |
AS:i |
比对得分 |
| +2 |
XN:i |
模糊匹配数,即匹配到多个位置的数量 |
| +3 |
XM:i |
错配数 |
| +4 |
XO:i |
比对过程中发生插入/删除(indel)事件的数量 |
| +5 |
XG:i |
比对中发生插入或删除碱基的总数 |
| +6 |
NM:i |
编辑距离 |
| +7 |
MD:Z |
read和参考序列之间的错配位置与类型 |
| +8 |
YT:Z |
比对类型 |
定量和基于注释的质量控制
1、在UCSC Table Browser上获得人类基因组注释文件:在assembly菜单选择Feb. 2009 (GRCh37/hg19);Group菜单选择Genes and gene predicitions;Track菜单选择Ensembl gene;region选择genome;output format选择BED – browser extensible data;output file写hg19_Ensembl_chr.bed(因为Ensembl数据集中染色体前缀包括“chr”)。
2、准备数据集
-
在ensembl上下载18号染色体的fasta文件。
1
|
wget -c https://ftp.ensembl.org/pub/release-74/fasta/homo_sapiens/dna/Homo_sapiens.GRCh37.74.dna.chromosome.18.fa.gz
|
-
使用wget命令下载wgEncodeCaltechRnaSeqH1hescR2x75Il200AlignsRep1V2.bam文件,它来自人类胚胎干细胞系,数据在加利福尼亚理工学院产生,来自早期Illumina平台。
1
|
wget -c http://hgdownload.cse.ucsc.edu/goldenPath/hg19/encodeDCC/wgEncodeCaltechRnaSeq/wgEncodeCaltechRnaSeqH1hescR2x75Il200AlignsRep1V2.bam
|
-
下载对应的注释文件。
1
|
wget -c http://hgdownload.cse.ucsc.edu/goldenPath/hg19/encodeDCC/wgEncodeCaltechRnaSeq/wgEncodeCaltechRnaSeqH1hescR2x75Il200AlignsRep1V2.bam.bai
|
为方便起见将文件分别重命名为H1Rep1.bam和H1Rep1.bam.bai
-
从H1Rep1.bam中提取比对到18号染色体的那一部分。
1
|
samtools view -b -o H1Rep1.18.bam H1Rep1.bam chr18
|
-
将H1Rep1.18.bam排序后制作索引
1
2
|
samtools sort -o H1Rep1.18.sorted.bam H1Rep1.18.bam
samtools index H1Rep1.18.sorted.bam
|
3、使用seq命令删除hg19_Ensembl_chr.bed文件中染色体名称的chr前缀(如有必要)。
1
|
sed 's/^chr//' hg19_Ensembl_chr.bed >hg19_Ensembl.bed
|
4、使用RSeQC中的read_distribution.py计算read对不同基因组特征类型的分布。
1
|
python3 ~/software/RSeQC-5.0.1/scripts/read_distribution.py -r hg19_Ensembl.bed -i H1Rep1.18.sorted.bam
|
结果将以表格形式报告read和tag的总数以及所属类型。
5、使用RSeQC中的geneBody_coverage.py可以生成一个覆盖图来检查转录本的覆盖是否均匀,即是否存在3’端或5’端偏差。
1
|
python3 ~/software/RSeQC-5.0.1/scripts/geneBody_coverage.py -r hg19_Ensembl_chr.bed -i H1Rep1.18.bam -o file
|
运行该程序需要R在$PATH上。
6、使用RPKM_saturation.py对read的子集重新取样,对每个子集按RPKM单位计算丰度,并检查他们是否稳定。
1
|
python3 ~/software/RSeQC-5.0.1/scripts/RPKM_saturation.py -r hg19_Ensembl_chr.bed -i H1Rep1.18.bam -o file
|
7、使用junction_annotation.py将剪接点划分为“新的”、“部分新”的和“已知的”,分别代表0个、1个、2个剪接位点在参考基因模型中。结果以饼图显示。
1
|
python3 ~/software/RseQC-5.0.1/scripts/junction_annotation.py -r hg19_Ensembl_chr.bed -i H1Rep1.18.bam -o file3
|
8、使用junction_saturation.py检查剪接点的测序饱和状态。软件将检测到的剪接点标记为新的、部分新的和已知的,并通过重新抽样分析其饱和状态。
1
|
python3 ~/software/RSeQC-5.0.1/scripts/junction_saturation.py -r hg19_Ensembl_chr.bed -i H1Rep1.18.bam -o file4
|
9、使用HTSeq-count输出每个基因的计数。HTSeq-count需要SAM/BAM格式的比对文件,以及一个GTF格式的基因组注释文件。Htseq-count期望双端数据按读段名称进行排序,同时BAM文件和注释文件应当有相同的基因名称,本例中需要将GTF文件中基因名称1、2…转化为chr1、chr2…
1
2
3
4
5
|
wget ftp://ftp.ensembl.org/pub/release-74/gtf/homo_sapiens/Homo_sapiens.GRCh37.74.gtf.gz
gunzip Homo_sapiens.GRCh37.74.gtf.gz
samtools sort -o H1Rep1.18.namesorted.bam H1Rep1.18.bam
sed 's/^\([0-9XYM]\)/chr**\1**/' Homo_sapiens.GRCh37.74.gtf > Homo_sapiens.GRCh37.74.chr.gtf
python3 ~/software/htseq-main/scripts/htseq-count -f bam --stranded no H1Rep1.18.namesorted.bam Homo_sapiens.GRCh37.74.chr.gtf >counts.txt
|
10、为了方便对差异进行统计检验,最好删除counts.txt的后5行。
1
|
head -n -5 counts.txt > genecounts.txt
|
至此,我们已经由原始的reads得到了每个基因的counts。下一步,我们将从counts往后进行分析。
讨论
讨论1:如何度量RNA-Seq数据的质量?
RNA-Seq读段基质量问题,如低置信度碱基问题,已经可以在原始读段水平上检测出,并且用phred64编码的形式报告在fastq文件中。当读段被作图到一个参考基因组,并且它们的位置与注释相匹配时,则可以进一步度量读段的质量,包括:
讨论2:如何度量基因表达丰度?
每个转录本生产呢个的read数目取决于很多因素,例如较长的转录本可能会产生较多的read,此外,转录组组成、GC偏差和随机引物也可能造成序列特异性偏差。为了比较不同不同基因之间的表达差异需要进行归一化处理。其中一个指标RPKM(reads per kilobase per million mapped reads,每百万作图的读段每千碱基的读段),由Mortazavi et.al引入:
$$
\text{RPKM} = \frac{\text{numReads}}{\left(\frac{\text{geneExonLength}}{1000}\right) \times \left(\frac{\text{totalNumReads}}{1000000}\right)}
$$
即,认为一条基因的read数与基因长度和总read数成正比,故将其作为分母除来归一化。这样可以在同一样本中比较不同基因的表达差异。
对于双端测序,可以使用指标FPKM(fragments per kilobase per million mapped reads,每百万作图的读段每千碱基的片段):
$$
\text{FPKM} = \frac{\text{numFragments}}{\left(\frac{\text{geneExonLength}}{1000}\right) \times \left(\frac{\text{totalNumFragments}}{1000000}\right)}
$$
这与RPKM非常的类似,Fragments指的是双端都匹配到同一个转录本上的read对,并且只计算一遍。此外,另一个指标称为TPM(transcript per million,每百万转录本):
$$
TPM_i = \frac{\frac{N_i}{L_i} \times 10^6}{\sum_{k=1}^{n} \frac{N_k}{L_k}} = \frac{RPKM_i}{\sum_{k=1}^{n} RPKM_k} \times 10^6
$$
其中Ni指匹配到第i个转录本的read数,Li是第i个转录本的长度。TPM相当于是将RPKM或FPKM归一化,使得在不同样本中可以比较相同基因的表达差异。
讨论3:操作中输出的counts.txt的数据结构。
该文件的最后几行如下所示:
1
2
3
4
5
6
7
8
|
ENSG00000273491 0
ENSG00000273492 0
ENSG00000273493 0
__no_feature 77237
__ambiguous 52848
__too_low_aQual 0
__not_aligned 0
__alignment_not_unique 93417
|
最后5行分别代表没有进行计数的原因和对应的读段数目:比对与任何基因均不重叠、其比对与多个基因重叠、对比质量低于阈值、完全没有比对以及比对到基因组中的多个位置。
Bulk-RNA测序下游分析——从counts开始
数据准备
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
|
#下载3个来自GM12892细胞系的BAM与BAI文件,以及4个来自H1hesc细胞系的BAM文件:
wget -c http://hgdownload.cse.ucsc.edu/goldenPath/hg19/encodeDCC/wgEncodeCaltechRnaSeq/wgEncodeCaltechRnaSeqGm12892R2x75Il200AlignsRep1V2.bam
wget -c http://hgdownload.cse.ucsc.edu/goldenPath/hg19/encodeDCC/wgEncodeCaltechRnaSeq/wgEncodeCaltechRnaSeqGm12892R2x75Il200AlignsRep2V2.bam
wget -c http://hgdownload.cse.ucsc.edu/goldenPath/hg19/encodeDCC/wgEncodeCaltechRnaSeq/wgEncodeCaltechRnaSeqGm12892R2x75Il200AlignsRep3V2.bam
wget -c http://hgdownload.cse.ucsc.edu/goldenPath/hg19/encodeDCC/wgEncodeCaltechRnaSeq/wgEncodeCaltechRnaSeqH1hescR2x75Il200AlignsRep1V2.bam
wget -c http://hgdownload.cse.ucsc.edu/goldenPath/hg19/encodeDCC/wgEncodeCaltechRnaSeq/wgEncodeCaltechRnaSeqH1hescR2x75Il200AlignsRep2V2.bam
wget -c http://hgdownload.cse.ucsc.edu/goldenPath/hg19/encodeDCC/wgEncodeCaltechRnaSeq/wgEncodeCaltechRnaSeqH1hescR2x75Il200AlignsRep3V2.bam
wget -c http://hgdownload.cse.ucsc.edu/goldenPath/hg19/encodeDCC/wgEncodeCaltechRnaSeq/wgEncodeCaltechRnaSeqH1hescR2x75Il200AlignsRep4V2.bam
#再分别重命名为GM1/2/3、H1/2/3/4 .bam
mv wgEncodeCaltechRnaSeqGm12892R2x75Il200AlignsRep1V2.bam GM1.bam
mv wgEncodeCaltechRnaSeqGm12892R2x75Il200AlignsRep2V2.bam GM2.bam
mv wgEncodeCaltechRnaSeqGm12892R2x75Il200AlignsRep3V2.bam GM3.bam
mv wgEncodeCaltechRnaSeqH1hescR2x75Il200AlignsRep1V2.bam H1.bam
mv wgEncodeCaltechRnaSeqH1hescR2x75Il200AlignsRep2V2.bam H2.bam
mv wgEncodeCaltechRnaSeqH1hescR2x75Il200AlignsRep3V2.bam H3.bam
mv wgEncodeCaltechRnaSeqH1hescR2x75Il200AlignsRep4V2.bam H4.bam
#下载人类基因组的注释文件,并将染色体名称加上“chr”。
wget ftp://ftp.ensembl.org/pub/release-74/gtf/homo_sapiens/Homo_sapiens.GRCh37.74.gtf.gz
sed 's/^\([0-9XYM]\)/chr\1/' Homo_sapiens.GRCh37.74.gtf Homo_sapiens.GRCh37.74.chr.gtf
#将分别提取18号染色体的子集。
samtools sort -o GM1.sorted.bam GM1.bam
samtools index GM1.sorted.bam
samtools view -b -o GM1.sorted.18.bam GM1.sorted.bam chr18
samtools sort -o GM2.sorted.bam GM2.bam
samtools index GM2.sorted.bam
samtools view -b -o GM2.sorted.18.bam GM2.sorted.bam chr18
samtools sort -o GM3.sorted.bam GM3.bam
samtools index GM3.sorted.bam
samtools view -b -o GM3.sorted.18.bam GM3.sorted.bam chr18
samtools sort -o H1.sorted.bam H1.bam
samtools index H1.sorted.bam
samtools view -b -o H1.sorted.18.bam H1.sorted.bam chr18
samtools sort -o H2.sorted.bam H2.bam
samtools index H2.sorted.bam
samtools view -b -o H2.sorted.18.bam H2.sorted.bam chr18
samtools sort -o H3.sorted.bam H3.bam
samtools index H3.sorted.bam
samtools view -b -o H3.sorted.18.bam H3.sorted.bam chr18
samtools sort -o H4.sorted.bam H4.bam
samtools index H4.sorted.bam
samtools view -b -o H4.sorted.18.bam H4.sorted.bam chr18
#转化为counts
python3 ~/software/htseq-main/scripts/htseq-count -f bam --stranded no GM1.sorted.18.bam Homo_sapiens.GRCh37.74.chr.gtf > GM1.txt
python3 ~/software/htseq-main/scripts/htseq-count -f bam --stranded no GM2.sorted.18.bam Homo_sapiens.GRCh37.74.chr.gtf > GM2.txt
python3 ~/software/htseq-main/scripts/htseq-count -f bam --stranded no GM3.sorted.18.bam Homo_sapiens.GRCh37.74.chr.gtf > GM3.txt
ython3 ~/software/htseq-main/scripts/htseq-count -f bam --stranded no H1.sorted.18.bam Homo_sapiens.GRCh37.74.chr.gtf > H1.txt
python3 ~/software/htseq-main/scripts/htseq-count -f bam --stranded no H2.sorted.18.bam Homo_sapiens.GRCh37.74.chr.gtf > H2.txt
python3 ~/software/htseq-main/scripts/htseq-count -f bam --stranded no H3.sorted.18.bam Homo_sapiens.GRCh37.74.chr.gtf > H3.txt
python3 ~/software/htseq-main/scripts/htseq-count -f bam --stranded no H4.sorted.18.bam Homo_sapiens.GRCh37.74.chr.gtf > H4.txt
#去除每个txt的后5行以便后续进行分析。
head -n -5 GM1.txt > GM1.count.txt
head -n -5 GM2.txt > GM2.count.txt
head -n -5 GM3.txt > GM3.count.txt
head -n -5 H1.txt > H1.count.txt
head -n -5 H2.txt > H2.count.txt
head -n -5 H3.txt > H3.count.txt
head -n -5 H4.txt > H4.count.txt
|
使用R语言进行分析
1、将7个样本的counts合并到一个表格,然后保存在本地。在本例中,7个txt文件在工作目录下的data文件夹里。
1
2
3
4
5
6
7
8
9
10
|
samples <- c(paste0('GM',1:3),paste0('H',1:4))
first.sample <- read.delim(paste0("C:\\Users\\admin\\Desktop\\Rscripts\\data\\", samples[1],".count.txt"),header = F, row.names = 1)
count.table <- data.frame(first.sample)
for(s in samples[2:length(samples)]){
fname <- paste0("C:\\Users\\admin\\Desktop\\Rscripts\\data\\", s, ".count.txt")
column <- read.delim(fname, header = F, row.names = 1)
count.table <- cbind(count.table,s=column)
}
colnames(count.table) <- samples
write.table(count.table,file = "count_table_chr18.txt",sep="\t",quote = F) #save as txt file
|
2、用DESeq包进行差异分析,差异基因存储在sig.deseq变量中。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
|
if (!require(DESeq2))
BiocManager::install("DESeq2")
library(DESeq2)
d.raw <- read.delim("count_table_chr18.txt",sep="\t")
d <- d.raw[rowSums(d.raw>3)>2,]
grp <- c(rep("GM",3),rep("hES",4))
cData <- data.frame(celltype = as.factor(grp))
rownames(cData) <- colnames(d)
d.deseq <- DESeqDataSetFromMatrix(countData = d,colData = cData,design = ~celltype)
d.deseq <- DESeq(d.deseq)
results(d.deseq)
res <- results(d.deseq,c("celltype","hES","GM"))
sig <- res[which(res$padj < 0.01),]
sig.deseq <- rownames(sig)
|
3、除此之外,还可以用不同的包进行分析,最后将几种方法得出的差异基因取交集。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
|
#limma
if (!require(limma))
install.packages("limma")
library(limma)
grp <- c("GM","GM","GM","hES","hES","hES","hES")
des <- model.matrix(~0+grp)
colnames(des) <- c("GM","hES")
contrast.matrix <- makeContrasts(GM-hES,levels=des)
d.norm <- voom(d,design=des)
fit <- lmFit(d.norm,des)
fit2 <- contrasts.fit(fit,contrast.matrix)
fit2 <- eBayes(fit2)
topTable(fit2,adjust="BH")
all <- topTable(fit2,adjust.method="BH",number=10000)
sig <- all[all$adj.P.Val < 1e-2,]
sig.limma <- rownames(sig)
limma <- rownames(sig)
#samr
if (!require(samr))
install.packages("samr")
if (!require(impute))
BiocManager::install("impute")
library(samr)
num.grp <- c(rep(1,3),rep(2,4))
samfit <- SAMseq(d,num.grp,resp.type="Two class unpaired",genenames=rownames(d),random.seed=101010,fdr.output=0.01,nperms=1000)
sig.sam <- c(samfit$siggenes.table$genes.up[,1],samfit$siggenes.table$genes.lo[,1])
#edgeR
if (!require(edgeR))
install.packages("edgeR")
library(edgeR)
edgeR.dgelist = DGEList(counts=d,group=factor(grp))
edgeR.dgelist = calcNormFactors(edgeR.dgelist,method="TMM")
edgeR.dgelist = estimateCommonDisp(edgeR.dgelist)
edgeR.dgelist = estimateTagwiseDisp(edgeR.dgelist,trend = "movingave")
edgeR.test = exactTest(edgeR.dgelist)
edgeR.pvalues = edgeR.test$table$PValue
edgeR.adjpvalues = p.adjust(edgeR.pvalues,method="BH")
sig.table <- edgeR.test$table[which(edgeR.adjpvalues <0.01),]
sig.edgeR <- rownames(sig.table)
|
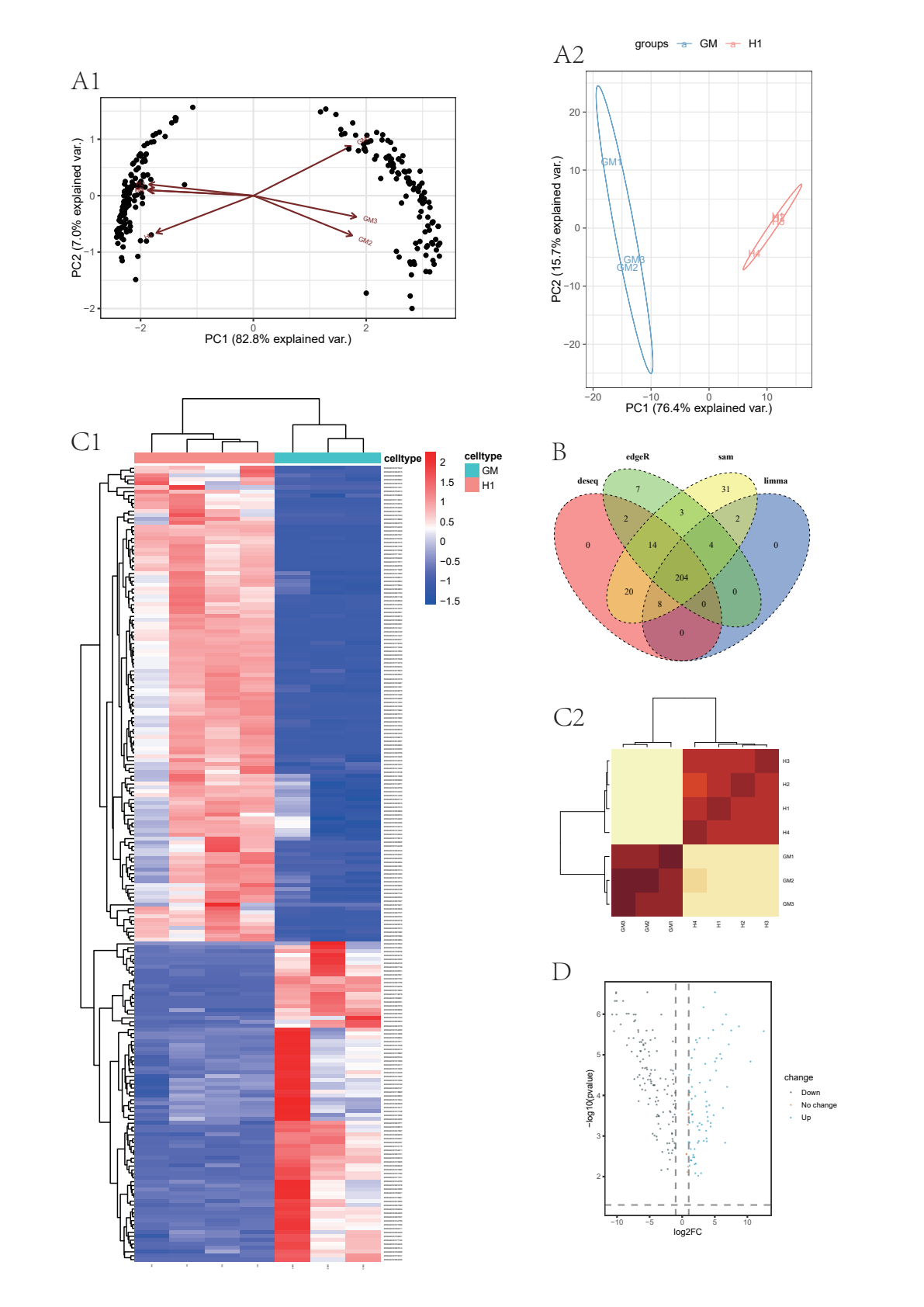
4、进行可视化处理,包括:进行主成分分析判断两组数据有何差异;对四种分析方法分析出的差异基因做Venn图并找出共有的差异基因;绘制热图可视化基因表达;绘制火山图进一步筛选基因。
-
主成分分析
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
|
# PCA GENE fig.A1
if (!require(ggbiplot))
install.packages("ggbiplot")
library(ggbiplot)
ct <- count.table[rownames(count.table) %in% sig.deseq,]
ct = t(scale(t(ct)))
ct.pca <- prcomp(ct,scale.=TRUE)
ggbiplot(
ct.pca,
choices=c(1,2),
obs.scale=1,
var.scale=1,
var.axes=T,
varname.size = 2,
varname.adjust = 2,
)+
theme_bw()+
theme(
legend.direction = 'horizontal',
legend.position = 'top',
legend.text = element_text(size = 10),
legend.title = element_text(size = 10)
)
ggsave('pca_gene.pdf',width=5,height=5,family="GB1")
# PCA TYPE fig.A2
coln = colnames(ct)
rown = rownames(ct)
ct=t(ct) #Transpose
colnames(ct)=rown
rownames(ct)=coln
ct <- ct[, colSums(ct != 0) > 0]
ct.pca <- prcomp(ct,scale.=TRUE)
ggbiplot(
ct.pca,
choices=c(1,2),
obs.scale=1,
var.scale=1,
var.axes=F,
labels=c(rownames(ct)),
groups=c("GM","GM","GM","H1","H1","H1","H1") ,
ellipse = TRUE,
ellipse.prob = 0.95,
)+
scale_color_manual(values=c('#70abd8','#fb9b8e'))+
theme_bw()+
theme(
legend.direction = 'horizontal',
legend.position = 'top',
legend.text = element_text(size = 10),
legend.title = element_text(size = 10)
)
ggsave('pca_type.pdf',width=5,height=5,family="GB1")
|
-
画出四组差异基因的Venn图。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
|
# Venn Graph fig.B
if (!require(VennDiagram))
BiocManager::install("VennDiagram")
library(VennDiagram)
gene.list = list(sig.deseq,sig.limma,sig.edgeR,sig.sam)
venn1 <- venn.diagram(
gene.list,
category.names = c("deseq","limma","edgeR","sam"),
alpha = 0.5,
cex = 2,
cat.cex = 2,
cat.fontface = "bold",
lty = 2,
cat.pos = 0,
filename = NULL,
resolution = 300,
fill = c("red", "blue", "green", "yellow"),
compression = "lzw"
)
pdf("venn.pdf",width = 10,height = 10)
grid.draw(venn1)
dev.off()
|
-
对差异基因绘制热图
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
|
# Pheat map fig.C1
if (!require(pheatmap))
install.packages("pheatmap")
library(pheatmap)
save_pheatmap_pdf <- function(x, filename, width=7, height=7) {
stopifnot(!missing(x))
stopifnot(!missing(filename))
pdf(filename, width=width, height=height)
grid::grid.newpage()
grid::grid.draw(x$gtable)
dev.off()
}
common_diff_genes <- Reduce(intersect, list(sig.deseq,sig.edgeR,sig.limma,sig.sam))
ct <- count.table[rownames(count.table) %in% common_diff_genes,]
ct = t(scale(t(ct)))
annotation_col <- data.frame(
celltype = c("GM","GM","GM","H1","H1","H1","H1")
)
rownames(annotation_col) <- colnames(ct)
pm <- pheatmap(
ct,
fontsize = 10,
fontsize_row = 2,
fontsize_col = 2,
display_numbers = F,
annotation_col = annotation_col,
color = colorRampPalette(colors = c("blue","white","red"))(100)
)
save_pheatmap_pdf(pm, "C:\\Users\\admin\\Desktop\\Rscripts\\pheatmap.pdf",6,12)
# Pheat map fig.C2
pdf("hm2.pdf",width=5,height=5)
heatmap(cor(ct),cexCol=0.75,cexRow=0.75)
dev.off()
|
-
绘制火山图、可视化差异基因的log2FC和P值。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
|
expr_matrix <- count.table[rownames(count.table) %in% common_diff_genes,]
GM_samples <- 1:3 # 前三列为 GM
H1_samples <- 4:7 # 后四列为 H1
sig2 <- sig[rownames(sig) %in% common_diff_genes,]
Gene_table = data.frame(rownames(sig2),sig2$logFC,sig2$adj.P.Val)
rownames(Gene_table) = Gene_table$rownames.sig2.
Gene_table = Gene_table[,-1]
colnames(Gene_table) <- c("log2FC","pvalue")
change = as.factor(ifelse(Gene_table$pvalue < 0.05 & abs(Gene_table$log2FC) > 1,
ifelse(Gene_table$log2FC > 1 ,'Up','Down'),'No change'))
pdf("vol.pdf",width=5,height=5)
ggplot(Gene_table,aes(log2FC, -log10(pvalue)))+
geom_hline(yintercept = -log10(0.05), linetype = "dashed", color = "#999999")+
geom_vline(xintercept = c(-1,1), linetype = "dashed", color = "#999999")+
geom_point(aes(color = change),
size = 0.2,
alpha = 0.5) +
theme_bw(base_size = 12)+
ggsci::scale_color_jama() +
theme(panel.grid = element_blank(),
legend.position = 'right')
dev.off()
|
图片