名词解释
原代细胞
指从体内取出组织细胞接种培养的第一代细胞。多为二倍体,分裂象少见,与体内组织相似性大。
细胞系
细胞系指从经原代培养后得到的一群可以长期传代的细胞。经过第一次传代培养后,原代培养细胞就称为一个细胞系。经过多次传代,细胞系中各细胞类型的占比趋于稳定,并多以一种细胞为主。
细胞株
若使用特定的方法,如克隆培养,物理细胞分离或其它选择方法再培养的细胞中确认出某种特定类型的细胞,并分离出这种细胞进行培养得到的细胞系即为细胞株。
细胞形态
黏附型细胞
上皮型细胞
泛指培养时类似上皮细胞的多种贴壁生长细胞,成扁平的不规则多角形,大小相仿,形态规整,细胞间相互衔接或呈镶嵌状紧密排列,生长时呈薄膜状移动。常见于起源于内、外胚层的细胞。
成纤维细胞型细胞
泛指培养时类似体内成纤维细胞的细胞,细胞多呈梭形、多角形、星形、扇形或不规则形,常向外伸出伪足。在多数情况下,细胞之间的排列疏松,有较大的细胞间隙。多见于起源于中胚层的细胞。
游走型细胞
泛指培养时类似巨噬细胞的细胞。该类型细胞在支持物上相互分散,一般不连接成片,细胞内易出现色暗的吞噬颗粒,常具有伪足。起源于网状内皮系统的细胞均属于此类型。主要为粒细胞、淋巴细胞、某些肿瘤细胞等。
多形型细胞
泛指一些形态上不规则的细胞,不具有稳定的细胞形态。常见于神经细胞。
悬浮型细胞
这一类型的细胞不需要贴于固体表面而生长,而是悬浮于培养基中,呈现球形。常见于血液和淋巴系统的细胞、大多数肿瘤细胞以及部分转化的细胞。
无菌原则
1、细胞超净台需要使用 75% 酒精擦拭超净工作台内部,并紫外消毒至少15分钟。(做完实验也应当进行这一步)
2、将物品转移至超净台前使用75%酒精喷洒消毒。
3、台面是无菌的,容器盖子应当向下扣(而不是反扣向上)。
4、废液缸区是相对污染区。
5、所有操作尽量悬空。此外,操作时手臂不要从打开的培养皿上方经过。
基本操作
细胞复苏
1、从-80℃冰箱中取出冻存管,浸入37℃水浴锅中(或放置在培养箱中解冻)约1min直至全部融化。
2、取出冻存管,吸取细胞悬液加入至15mL离心管中,并加入10倍以上培养液(一共约10mL左右),用移液枪吹打混匀。
3、离心,1000rpm,5min(3min)。
4、弃去上清液,并使用移液枪充分吸净残留液体。用一次性塑料滴管加入数mL培养液重悬细胞并反复吹打混匀,使细胞密度在合适的值(1*10^6个/mL)(可以用细胞计数仪)。
5、将细胞悬液转移至培养皿中,轻轻晃匀,贴上封口膜,将其放入 37℃、5% CO₂培养箱中培养。
6、每24h取出,观察细胞生长情况,更换培养液。
细胞传代
1、取出培养基,观察细胞生长情况,确保细胞会和度达80-95%(指数生长期)。
2、倒掉培养基并用移液枪吸净,再用PBS缓冲液冲洗1-2次以彻底清除残留的培养基和细 胞代谢产物。
3、加入胰酶-EDTA消化液适量(没过细胞)并置于37℃培养箱中消化1-5分钟。需密切观察细胞形态变化,当细胞开始变圆、收缩并逐渐从培养容器底部脱离时,用手轻轻拍打培养容器的侧壁,帮助细胞完全脱落。
4、加入等体积的完全培养基终止消化,并用移液枪轻轻吹打培养容器内的液体,使细胞均匀分散成单个细胞悬液。
5、将细胞悬液加入至15mL离心管中。
6、离心,1000rpm,5min(3min)。
7、弃去液体并用移液枪吸净。
8、向离心管中加入3mL预热的细胞培养基,使用移液枪轻轻吹打细胞沉淀,使细胞重新悬浮。
9、取少量细胞悬液,用细胞计数仪测量细胞的浓度,再根据传代的比例计算所需的细胞悬液体积与培养液体积。一般要求目标细胞浓度为1*10^5个/mL。
10、轻轻晃动培养容器,使细胞均匀分布在容器底部,然后将其放入 37℃、5% CO₂培养箱中继续培养。
细胞冻存
1、在冻存前一天,更换新鲜的完全培养基,确保细胞处于最佳生长状态(指数生长期)。
2、取出培养基,观察细胞生长情况,确保细胞会和度达80-95%(指数生长期)。
3、倒掉培养基并用移液枪吸净,再用PBS缓冲液冲洗2次以彻底清除残留的培养基和细胞代谢产物。
4、加入胰酶-EDTA消化液适量(没过细胞)并置于37℃培养箱中消化1-2分钟。需密切观察细胞形态变化,当细胞开始变圆、收缩并逐渐从培养容器底部脱离时,用手轻轻拍打培养容器的侧壁,帮助细胞完全脱落。
5、加入等体积的完全培养基终止消化,并用移液枪轻轻吹打培养容器内的液体,使细胞均匀分散成单个细胞悬液。
6、将细胞悬液加入至15mL离心管中。
7、离心,1000rpm,5min(3min)。
8、弃去液体并用移液枪吸净。
9、根据细胞沉淀的量,加入适量预冷的冻存液,一般按照1×10^6 - 5×10^6个/ml细胞密度进行重悬。(每管分装的细胞悬液体积一般为 1-1.5mL。)/ 每个冻存管内加入1mL细胞悬液,故冻几管就加入几mL细胞悬液。
- 这一步可以使用胶头滴管
- 冻存细胞每管推荐大约使用1个10cm培养基中的所有细胞,不过多一点或少一点也没有影响
10、对于使用快速冻存液的情况,直接放置入-80℃冰箱进行冻存。
细胞铺板
1、取出培养基,观察细胞生长情况,确保细胞会和度达80-95%(指数生长期)。
2、倒掉培养基并用移液枪吸净,再用PBS缓冲液冲洗1-2次以彻底清除残留的培养基和细 胞代谢产物。
3、加入胰酶-EDTA消化液适量(没过细胞)并置于37℃培养箱中消化1-5分钟。需密切观察细胞形态变化,当细胞开始变圆、收缩并逐渐从培养容器底部脱离时,用手轻轻拍打培养容器的侧壁,帮助细胞完全脱落。
4、加入等体积的完全培养基终止消化,并用移液枪轻轻吹打培养容器内的液体,使细胞均匀分散成单个细胞悬液。
5、将细胞悬液加入至15mL离心管中。
6、离心,1000rpm,5min(3min)。
7、弃去液体并用移液枪吸净。
8、向离心管中加入3mL预热的细胞培养基,轻轻吹打细胞沉淀,使细胞重新悬浮。
9、采取少量细胞悬液进行细胞计数,得到细胞的浓度为 $c\ 个/mL$。
10、计算:
- 设当前剩余溶液体积为$V\ mL$,细胞浓度为$c\ 个/mL$,96孔板需要铺$n$个孔,每孔要求细胞$x$个,体积为$v\ mL$:
- 则所需细胞悬液稀释比例为$\frac{c\cdot v}{x}$。
- 例如,当前剩余3mL,细胞浓度为$3*10^6$个/mL,需要铺180个孔,每孔要求细胞3000个,100μL,则一共需要18mL细胞悬液,其中需$\frac{18\cdot 3000}{3\cdot 10^6\cdot 100\cdot 10^{-3}} = 0.18 \ mL$原细胞悬液以及$17.82mL$培养基。当然,可以多准备一些细胞悬液以防止加样过程中的损耗,如准备30mL细胞悬液,其中需加入$0.3\ mL$原细胞悬液。
11、加样。
- 对于96孔板,每个孔是200μL体系,其中包括100μL细胞悬液以及100μL药物
12、孵育。
- 将96孔板放置在37℃,5%CO2的培养箱中培养适当时间
细胞爬片
1、选择爬片。爬片可以是普通盖玻片、专用细胞爬片或者商业化的带有爬片的培养板。将剪裁好的爬片,置于浓硫酸中浸泡并过夜,第二天先用自来水冲洗20遍,再置于无水酒清中浸泡6小时,再用三蒸水冲洗3遍,放在饭盒或者玻璃培养皿中烘干后进行高压消毒。
2、胰酶消化细胞后计数,重悬细胞于完全培养基中。
3、加细胞前,根据玻片的大小,先在每个孔里准备放爬片的位置滴少量培养基,使玻片与培养皿靠培养基的张力粘合到一起,然后放玻片,防止加细胞悬液时玻片漂起,造成双层细胞贴片。
4、根据自己的需要选择合适的细胞密度接入培养板内即可。
5、待细胞贴壁后,可去上清加含药培养基。
6、固定爬片。
7、按照实验设计,作用一定时间后取玻片。取玻片时由于玻片与培养皿底结合较紧,张力较大,一般将注射器针头针尖向背面弄个小钩,这样将爬片轻轻勾起,用小镊子取出即可。
固定爬片
根据实验需求选择合适的固定液:
- 4%多聚甲醛:可用于免疫电镜、免疫荧光以及TUNEL染色。
- 冷丙酮(即-20℃的丙酮):可用于一般的免疫组化染色。
- 95%乙醇:可用于免疫组化。
- 甲醛
1、吸干培养基,加入PBS浸泡3min后吸去,重复三次。
2、加入适量的4%多聚甲醛,静置15min后吸去。
3、PBS冲洗三次。
4、加入适量PBS,4℃冰箱保存。或室温固定15分钟后,将表面液体吹干,入-20℃保存。
培养基的配置
DMEM·高糖 培养基
DMEM是一种含各种氨基酸和葡萄糖的培养基,是在MEM培养基的基础上研制的。与MEM比较增加了各种成分用量,同时又分为高糖型(高于4500mg/L)和低糖型(低于1000mg/L)。高糖型有利于细胞停泊于一个位置生长,适于生长较快、附着较困难肿瘤细胞等。
在使用的时候还需要加入胎牛血清FBS和三抗(青霉素-链霉素-两性霉素)配成最终的细胞培养基,其比例为90%的DMEM、10%的FBS以及1%的三抗。例如配置50mL的培养基需要45mL的DMEM、5mL的FBS以及500μL的三抗。实际使用的时候可以直接将FBS以及三抗加入至大瓶DMEM培养基中。
- DMEM应当放置在4℃冰箱保存。
- FBS应当放置在-20℃冰箱保存,在使用前一天放置在4℃冰箱内保存。
- 三抗应当放置在-20℃冰箱保存,在使用前一天放置在4℃冰箱内保存。也可以在4℃冰箱内较长时间保存
F12K 培养基
Ham’s F-12K (Kaighn’s)培养基(简称F12K培养基)是Ham’s F-12营养混合物的改良产品,在传统F12培养基的基础上,提高了某些氨基酸和丙酮酸钠的含量,并且添加了传统培养基中没有的物质(如腐胺、胸苷、次黄嘌呤等),可用于培养减血清环境中的部分大鼠和肌酐细胞以及人原代细胞。
细胞增殖-毒性(活性)检测 CCK-8法
CCK-8试剂中的WST-8被细胞内的脱氢酶氧化还原后生成橙黄色的甲臜染料。将试剂加入至96孔板中并孵育一段时间后每孔在450nm处的吸光值与该孔的细胞数目以及细胞活性有关。
1、制备细胞悬液,计数。
2、在96孔板中接种细胞悬液,每孔约100μl,至少1000个细胞(最好3000左右)。同样的样本可做6个重复。
3、将培养板放入培养箱中预培养一段时间,细胞贴壁需要大约2-4h,如果是悬浮细胞,该步骤可以省去。
4、向培养板各孔中加入不同浓度的毒性物质。需要有一个空白组(无细胞、±待测物质的培养基)、一个对照组(有细胞、无待测物质的培养基),以及各个浓度梯度待测物质的组。此外,在最外面一圈还可以单加入培养基以防蒸发。
5、将培养板放入培养箱中孵育一段时间,例如6、12、24、48h,具体时间要看待测物质的性质和细胞的敏感性。如果待检测物质有氧化性或还原性,可在加入CCK-8之前更换新鲜培养基(并且是不加胎牛血清以及三抗的培养基),总计100μL,以去掉待测物质的影响。如果影响比较小或者没有影响,可以不更换培养基,直接扣除培养基中加入药物后的空白吸收即可。
- 虽然不更换培养基也没有太大问题,但是还是建议更换无血清的培养基
6、向每孔中加入10μL CCK-8溶液,由于加入的CCK-8量比较少,可能会因试剂沾在孔壁上而带来误差,建议在加完试剂后轻轻晃动培养板以帮助混匀。
7、将培养板放入培养箱中孵育1-4h。因为细胞种类不同,形成的formazan的量也不一样,所以如果显色不够的话,可以延长培养时间,特别是血液细胞形成的formazan很少,需要较长的显色时间(5-6h)。
8、用酶标仪测定450nm处的吸光度(OD)。
9、导出数据、绘图。

细胞活性氧检测

活性氧检测试剂盒(Reactive Oxygen Species Assay Kit,也称ROS Assay Kit)是一种利用荧光探针DCFH-DA进行活性氧检测的试剂盒。DCFH-DA本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成DCFH。而DCFH不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF。检测DCF的荧光就可以知道细胞内活性氧的水平。剂盒提供了活性氧阳性对照试剂Rosup,以便于活性氧的检测。
1、对于刺激时间较短(通常为2小时以内)的细胞,先装载探针,后用活性氧阳性对照或自己感兴趣的药物刺激细胞。对于细胞刺激时间较长(通常为6小时以上)的细胞,先用活性氧阳性对照或自己感兴趣的药物刺激细胞,后装载探针。
- **原位装载探针:**本方法仅适用于贴壁培养细胞。按照1:1000用细胞外液(C0216)或酌情使用PBS、HBSS等适当溶液稀释DCFH-DA,使终浓度为10微摩尔/升。去除细胞培养液,加入适当体积稀释好的DCFH-DA。加入的体积以能充分盖住细胞为宜,通常对于六孔板的一个孔加入稀释好的DCFH-DA不少于1毫升。37ºC细胞培养箱内孵育20分钟。用细胞外液(C0216)或酌情使用PBS、HBSS、无血清细胞培养液等适当溶液洗涤细胞三次,以充分去除未进入细胞内的DCFH-DA。通常活性氧阳性对照在刺激细胞20-30分钟后可以显著提高活性氧水平。阳性对照Rosup可以按照1:1000的比例酌情使用PBS、HBSS、细胞外液或无血清培养液稀释后使用。例如装载好探针的细胞,直接吸除液体或离心后吸除液体,加入适当体积的按照1:1000稀释的Rosup阳性对照刺激。通常刺激后20-30分钟内可以观察到非常显著的活性氧水平升高。
- **收集细胞后装载探针:**按照1:1000用细胞外液(C0216)或酌情使用PBS、HBSS等适当溶液稀释DCFH-DA,使终浓度为10微摩尔/升。细胞收集后悬浮于稀释好的DCFH-DA中,细胞浓度为一百万至二千万/毫升,37ºC细胞培养箱内孵育20分钟。每隔3-5分钟颠倒混匀一下,使探针和细胞充分接触。用细胞外液(C0216)或酌情使用PBS、HBSS、无血清细胞培养液等适当溶液洗涤细胞三次,以充分去除未进入细胞内的DCFH-DA。直接用活性氧阳性对照或自己感兴趣的药物刺激细胞,或把细胞等分成若干份后刺激细胞。通常活性氧阳性对照在刺激细胞20-30分钟后可以显著提高活性氧水平。
2、对于原位装载探针的样品可以用激光共聚焦显微镜直接观察,或收集细胞后用荧光分光光度计、荧光酶标仪或流式细胞仪检测。对于收集细胞后装载探针的样品可以用荧光分光光度计、荧光酶标仪或流式细胞仪检测,用激光共聚焦显微镜直接观察也可以。
3、使用488nm激发波长,525nm发射波长,实时或逐时间点检测刺激前后荧光的强弱。DCF的荧光光谱和FITC非常相似,可以用FITC的参数设置检测DCF。DCF的激发光谱和发射光谱参考下图。
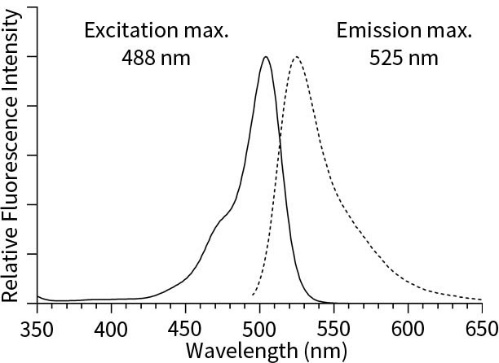
超氧阴离子活性氧检测

碧云天研发生产的超氧阴离子活性氧检测试剂盒(DHE) (Reactive Oxygen Species Assay Kit for Superoxide Anion with DHE),简称ROS Assay Kit for Superoxide Anion with DHE,是一种以DHE为荧光探针,快速灵敏地检测细胞内超氧阴离子活性氧的试剂盒。本试剂盒可使用荧光显微镜、激光共聚焦显微镜、流式细胞仪、荧光酶标仪等荧光检测系统进行检测。
活性氧(Reactive oxygen species, ROS)主要包括超氧阴离子(·O2-)、过氧化氢(H2O2)、羟自由基(·OH)等。在细胞或组织的正常生理代谢过程中会产生活性氧,同时一些环境因素例如紫外照射、γ射线照射、环境污染等也可以诱导活性氧的产生。活性氧产生后,可以导致细胞内脂、蛋白和DNA等的氧化损伤,诱发氧化应激(Oxidative stress),继而可能导致肿瘤、动脉粥样硬化、风湿性关节炎、糖尿病、肝损伤、以及中枢神经系统疾病等。
Dihydroethidium(二氢乙啶)简称DHE,是最常用的检测细胞内超氧化物阴离子水平的荧光探针。分子式为C21H21N3,分子量为315.41。
Dihydroethidium是一种最常用的超氧化物阴离子荧光检测探针。可以直接用于活细胞的标记。Dihydroethidium被活细胞摄入后,可以在细胞内的超氧化物阴离子作用下脱氢,产生Ethidium。Ethidium (例如溴化乙锭)可以和RNA或DNA结合产生红色荧光。当细胞内的超氧化物阴离子水平较高时,产生的Ethidium较多,红色荧光就较强,反之则较弱。这样就可以用dihydroethidium进行超氧化物阴离子水平的检测[2]。
Dihydroethidium本身为蓝色荧光,最大激发波长为370nm,最大发射波长为420nm,脱氢后和RNA或DNA结合产生红色荧光,最大激发波长为300nm,最大发射波长为610nm,实际观察时也可以使用535nm作为激发波长。
1、DHE染色液的配制。
按照96孔板每孔100μl DHE染色液(DHE Staining Solution)的体系,参考下表配制适量的 DHE染色液,并充分混匀。
- 配制DHE染色液时注意避光,且须现配现用,稀释后不能长期保存。
- DHE最优先的推荐终浓度为1X,对大多数细胞都适用,但为了得到更理想的结果,对于不同类型的细胞请自行进行一定摸索,DHE的终浓度通常为0.5-2X。
- 试剂盒提供的Assay Buffer可在一段时间内维持细胞的正常状态,并给细胞提供一定的营养,效果比PBS或HBSS更好。也可以使用Assay Buffer外的其它合适的溶液配制,如无血清培养液、HBSS (C0218)或PBS等稀释DHE (1000X)。
| Samples |
1 |
10 |
100 |
| DHE (1000X) |
0.1μl |
1μl |
10μl |
| Assay Buffer |
99.9μl |
999μl |
9.99ml |
| DHE Staining Solution |
100μl |
1ml |
10ml |
2、设置阳性对照:将试剂盒中提供的超氧阴离子活性氧阳性对照Rosup II (1000X)按照推荐的1:1000的比例加入到细胞培养液中,通常处理细胞30-120分钟即可,具体处理时间可以根据细胞种类适当调整。随后按照下述各种检测方法的步骤加入DHE染色液,进行检测。
3、荧光显微镜检测:
- 接种培养。将细胞接种于96孔板等多孔板、细胞培养皿中或者细胞爬片上,按实验设计对细胞进行一定处理。
- 洗涤(选做)。对于贴壁细胞,吸除培养液,用PBS洗涤细胞1次;对于悬浮细胞,250-1000×g室温离心5分钟,吸除上清,用PBS洗涤1次。酚红或血清对于本试剂盒的检测有一定的干扰,吸除培养液和PBS时推荐使用真空泵。在能充分吸净残留液体的情况下,可以不使用PBS洗涤。
- 染色。加入适当体积的DHE染色液。通常96孔板每孔加入100μl,24孔板每孔加入250μl,12孔板每孔加入500μl,6孔板每孔加入1ml。37ºC避光孵育20分钟。孵育时间可在10-30分钟之间进行调整。如果是首次实验不能确定孵育时间,建议先尝试37ºC孵育20分钟,观察荧光效果。如果正常细胞染色较深,则适当缩短时间;如果荧光强度太弱,则适当延长时间。
- 检测。孵育结束后可以直接在荧光显微镜下观察染色效果。如果发现荧光背景比较高,可以酌情洗涤1-3次后再在荧光显微镜下观察染色效果。DHE为红色荧光,Ex/Em = 535/610nm。
细胞DNA损伤检测
碧云天生产的DNA损伤检测试剂盒(γ-H2AX免疫荧光法, 兔单抗, 红色),英文名为DNA Damage Assay Kit by γ-H2AX Immunofluorescence (Rabbit Monoclonal Antibody and Red Fluorescence),是通过免疫荧光染色检测DNA损伤标记物γ-H2AX (即磷酸化的H2AX)的含量以确认DNA是否损伤的检测试剂盒。本试剂盒中的γ-H2AX兔单抗可以识别人、小鼠或大鼠的γ-H2AX,因此本试剂盒可以通过荧光显微镜或高内涵筛选(High content screening, HCS)等检测人、小鼠或大鼠等细胞或组织中的DNA损伤。
根据DNA损伤的原理,DNA的损伤检测试剂盒可以分为三类:基于损伤DNA理化性质的改变检测DNA损伤,如彗星实验;基于分子杂交检测DNA损伤,如荧光原位杂交法(FISH);以及基于DNA损伤后形成的产物检测DNA损伤,如磷酸化的H2AX、暴露的3’-OH (TUNEL)和8-OHdG等。前两种方法是基于荧光标记直接观测DNA的损伤情况,而基于DNA损伤后形成的产物检测DNA损伤是通过标记物的检测间接反映DNA的损伤程度[1-3]。本试剂盒是通过DNA损伤后形成的磷酸化的H2AX Ser139产物(即γ-H2AX或γH2AX)间接评估DNA的损伤,也被称为DNA双链断裂染色检测试剂盒(DNA Double Strand Break (DSB) Staining Kit)、细胞双链DNA断裂检测试剂盒(Cellular DNA Double Strand Break Assay Kit)、或H2AX磷酸化检测试剂盒(H2AX Phosphorylation Assay Kit)。
常见的DNA损伤有碱基修饰、DNA链内和链间交联、DNA单链断裂(DNA single strand-breaks, SSBs)以及DNA双链断裂(DNA double-strand breaks, DSBs)等,其中DNA双链断裂被认为是最严重的DNA损伤。引起DNA产生双链断裂的物理或化学因素有紫外线照射、电离辐射(X、γ射线等)、遗传毒性化学物质和化疗药物等。DSBs的无效修复或错误修复可以引发基因组紊乱,最终导致肿瘤及其它相关疾病的发生。
H2AX,全称为H2A histone family member X,也可简称为H2A.X,是染色体组蛋白H2A的变异体之一。在细胞DNA双链发生断裂时,磷脂酰肌醇3激酶(PI3K)相关激酶(Phosphatidylinositol 3-kinase-related kinases, PIKKs)家族成员中的ATM (Ataxia-telangiectasia mutated protein)、ATR (ATM and RAD3-related)等使H2AX上的第139位丝氨酸发生磷酸化修饰,形成磷酸化的H2AX,即γ-H2AX。H2AX磷酸化产生的γ-H2AX含量水平可以清楚地反映出DNA的损伤程度及修复情况,而被广泛应用于DNA损伤和细胞凋亡研究中,成为一种重要的DNA损伤标记物。γ-H2AX常用于DNA损伤的细胞或动物模型的检测,也广泛应用于化合物的遗传毒性检测以及临床中肿瘤的早期筛查与治疗效果的评价。
1、吸除培养液,用PBS洗涤1次。
2、加入固定液,固定5-15分钟。固定液的用量充分盖住样品即可,对于6孔板中的样品,通常每孔加入1ml固定液。对于96孔板中的样品,通常每孔加入100μl固定液,其它多孔板的用量可以适当参考执行,后续以6孔板为例进行描述。
3、吸除固定液,用洗涤液洗涤3次,每次3-5分钟。
4、加入免疫染色封闭液,室温封闭10-20分钟。免疫染色封闭液的用量充分盖住样品即可,对于6孔板中的样品,通常加入1ml免疫染色封闭液。
5、吸除免疫染色封闭液,加入γ-H2AX兔单抗,室温孵育1小时或4ºC孵育过夜。γ-H2AX兔单抗的用量充分盖住样品即可,对于6孔板或96孔板中的样品,通常分别加入1ml或50μl γ-H2AX兔单抗。
6、小心吸出γ-H2AX兔单抗到适当的容器内,4ºC保存,留做下次使用。注:γ-H2AX兔单抗通常至少可以重复使用5次。
7、洗涤液洗涤3次,每次5-10分钟。
8、加入抗兔Cy3,室温孵育1小时。抗兔Cy3的用量充分盖住样品即可,对于6孔板中的样品,通常加入1ml抗兔Cy3。
- Cy (Cyanine)系列,也叫菁染料,即花青素系列荧光染料是具有多聚次甲基桥链化学结构特点的一类合成荧光染料。Cy染料的次甲基桥链(1-7个次甲基)两端常常连着两个氮原子,其中一个氮原子带正电,从而Cy染料形成具有离域正电荷效应的介离子化合物。因为这个结构特点,Cy染料的消光系数(extinction coefficient)非常高。桥链长度和两端的发色团直接控制着染料的吸收峰和发射峰值,从而让Cy系列染料可以覆盖从紫外到远红外的几乎所有常用荧光谱带。
9、小心吸出抗兔Cy3到适当的容器内,4ºC保存,留做下次使用。注:抗兔Cy3通常至少可以重复使用5次。
10、洗涤液洗涤2次,每次5-10分钟。
11、加入细胞核染色液(DAPI),室温染色5分钟左右。细胞核染色液的用量充分盖住样品即可,对于6孔板中的样品,通常加入1ml细胞核染色液(DAPI)。
12、吸除细胞核染色液,用洗涤液洗涤3次,每次3-5分钟。
13、如果是6孔板等较大的孔板,可以滴加适当量的抗荧光淬灭封片液,盖玻片封片后荧光显微镜下观察。如果是96孔板,通常可以在保留洗涤液的情况下直接进行观察和拍照,或使用高内涵分析仪进行拍照分析。γ-H2AX的染色为红色荧光,细胞核的DAPI染色为蓝色荧光。
Edu增殖检测
本产品通过在DNA合成过程中掺入胸腺嘧啶脱氧核苷(thymidine)类似物 EdU(5-ethynyl-2’-deoxyuridine),并在随后的点击反应(Click reaction)中将EdU标记上荧光染料Alexa Fluor 488,从而实现对细胞增殖进行简单、快速、高灵敏的检测,其检测对象包括培养的细胞或组织样品,也可检测组织切片。经试剂盒处理后的增殖细胞在荧光显微镜下发出非常明亮的绿色荧光,可用于荧光显微镜、激光共聚焦显微镜、流式细胞仪及荧光酶标仪等的检测,也可进行高内涵筛选(High-Content Screening,HCS)。需注意的是,流式细胞仪或荧光酶标仪检测仅适用于细胞样品,不可用于组织切片。
1、在6孔板中(如有必要可以放入盖玻片)培养适量细胞。待细胞培养过夜且恢复到正常状态后,进行所需的药物处理或者其它刺激处理等。
2、配制2×EdU工作液:推荐EdU终浓度为10 μM(1×),用细胞培养液1:500稀释EdU(10 mM)即可得 到2×EdU工作液(20 μM);
3、将37℃预热的2×EdU工作液(20 μM),按与培养液相同体积加入6孔板中,使6孔板中的EdU终 浓度变为1×。例如设计终浓度为10 μM,原先6孔板中的培养基为1 mL,则只需将1 mL 2×的EdU 工作液(20 μM)加入到孔板中即可;
4、继续孵育细胞2 h。该孵育时间的长短取决于细胞生长速率,通常继续孵育时间以细胞周期10%左右为宜。
5、细胞的EdU标记完成后,吸弃培养液,并加入1 mL固定液 ,室温固定15 min。
6、去除 固定液 ,每孔加入1 mL 洗涤液 洗涤细胞3次,每次3~5 min。
7、去除 洗涤液 ,每孔加入1 mL 通透液 ,室温孵育10~15 min。
8、去除 通透液 ,每孔用1 mL洗涤液 洗涤细胞12次,每次35 min。
9、配制Click Additive Solution:对于 CX002,用 1.5 mL 去离子水溶解一管Click Additive,混匀至全 部溶解,即为 Click Additive Solution;对于 CX002L,加入 12 mL 去离子水溶解试剂盒所提供的一 瓶Click Additive,混匀至全部溶解,即为Click Additive Solution。配制完成后可以分装保存于-20℃。
10、按照表格配置Click反应液,并且在配置完15min内使用。
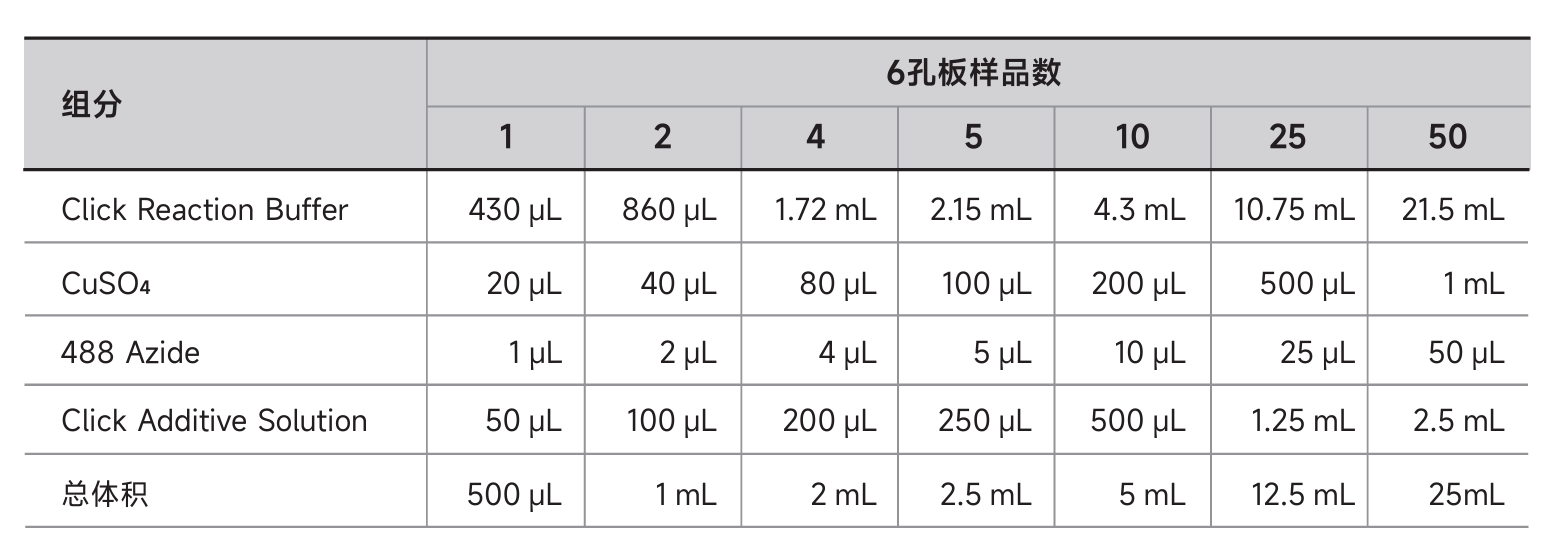
11、去除上一步骤中的洗涤液。
12、每孔加入0.5 mL Click反应液 ,轻轻摇晃细胞培养板以确保反应混合物将样品均匀覆盖。
13、室温避光孵育30 min,也可酌情适当延长孵育时间。
14、吸除Click 反应液 ,用 洗涤液 洗涤3次,每次3~5 min。
15、如果需要对细胞核进行染色,可以参照步骤 细胞核染色 进行。如无其它的特殊需求,即可在荧光 显微镜下观察,或使用流式细胞仪、多功能酶标仪等进行荧光检测。488 Azide的最大激发波长是 495 nm,最大发射波长是519 nm;